-
Chemistry
-
Voltaic cell
-
Age 16+
-
level: 12
-
English
Author's Instructions
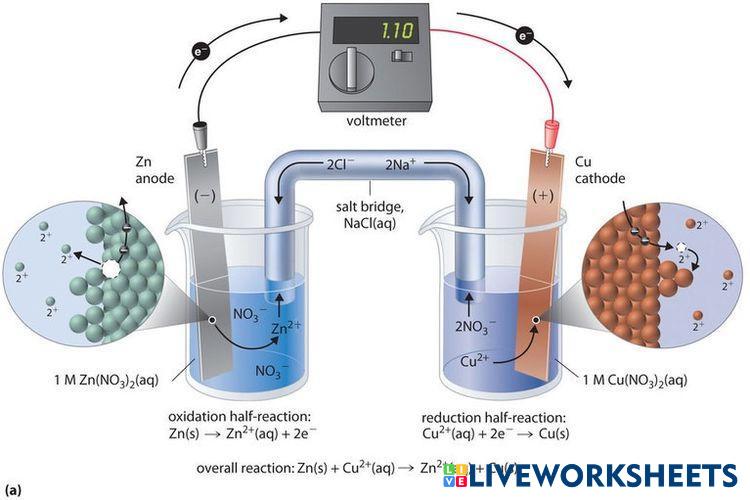
Sel volta adalah alat atau sel elektrokimia yang digunakan untuk mengubah energi kimia menjadi energi listrik melalui reaksi redoks spontan. Sel volta terdiri dari dua elektroda yang biasanya terbuat dari logam berbeda dan dicelupkan dalam larutan elektrolit masing-masing. Komponen utama dalam sel volta adalah:
- Anoda: Elektroda tempat terjadinya oksidasi (pelepasan elektron). Anoda bermuatan negatif dalam sel volta.
- Katoda: Elektroda tempat terjadinya reduksi (penangkapan elektron). Katoda bermuatan positif dalam sel volta.
- Jembatan Garam: Tabung berisi larutan garam yang berfungsi menjaga keseimbangan muatan dalam larutan agar reaksi dapat berlangsung terus.
Sel volta terkenal dengan reaksi spontan yang terjadi di dalamnya, yang menghasilkan aliran listrik. Contoh sederhana dari sel volta adalah sel Daniell, yang menggunakan seng (Zn) sebagai anoda dan tembaga (Cu) sebagai katoda. Reaksi dalam sel Daniell dapat ditulis sebagai berikut:
- Reaksi di anoda: Zn(s) → Zn²⁺(aq) + 2e⁻
- Reaksi di katoda: Cu²⁺(aq) + 2e⁻ → Cu(s)
Sel volta ini penting dalam konteks baterai dan sumber energi portabel lainnya karena prinsipnya digunakan dalam banyak perangkat penghasil listrik.
-
Chemistry
-
Voltaic cell
-
Age 16+
-
level: 12
-
English
Author's Instructions
Sel volta adalah alat atau sel elektrokimia yang digunakan untuk mengubah energi kimia menjadi energi listrik melalui reaksi redoks spontan. Sel volta terdiri dari dua elektroda yang biasanya terbuat dari logam berbeda dan dicelupkan dalam larutan elektrolit masing-masing. Komponen utama dalam sel volta adalah:
- Anoda: Elektroda tempat terjadinya oksidasi (pelepasan elektron). Anoda bermuatan negatif dalam sel volta.
- Katoda: Elektroda tempat terjadinya reduksi (penangkapan elektron). Katoda bermuatan positif dalam sel volta.
- Jembatan Garam: Tabung berisi larutan garam yang berfungsi menjaga keseimbangan muatan dalam larutan agar reaksi dapat berlangsung terus.
Sel volta terkenal dengan reaksi spontan yang terjadi di dalamnya, yang menghasilkan aliran listrik. Contoh sederhana dari sel volta adalah sel Daniell, yang menggunakan seng (Zn) sebagai anoda dan tembaga (Cu) sebagai katoda. Reaksi dalam sel Daniell dapat ditulis sebagai berikut:
- Reaksi di anoda: Zn(s) → Zn²⁺(aq) + 2e⁻
- Reaksi di katoda: Cu²⁺(aq) + 2e⁻ → Cu(s)
Sel volta ini penting dalam konteks baterai dan sumber energi portabel lainnya karena prinsipnya digunakan dalam banyak perangkat penghasil listrik.
 📚 New Feature: Share worksheets & get automatic grading via Google Classroom 🎓
📚 New Feature: Share worksheets & get automatic grading via Google Classroom 🎓